GASTROENTEROLÓGIA SKÁRSKE NOVIN december/2024/ročník V
Mikroenkapsulovaný butyrát sodný a synbiotiká v liečbe pacientov so syndrómom dráždivého čreva
MUDr. Júlia Zapotocká1; MUDr. Mária Zakuciová2
1 Gastroenterologická ambulancia Košice
2 II. interná klinika Univerzitnej nemocnice L. Pasteura Košice a UPJŠ LF
Úvod
Funkčné poruchy gastrointestinálneho traktu tvoria značne heterogénnu skupinu rôznych symptómov, syndrómov a chorôb. Vyznačujú sa komplexom nepríjemných a/alebo bolestivých subjektívnych vnemov pacienta spojených s trávením v žalúdku (žalúdočná dyspepsia, dyspepsia horného typu) alebo v črevách (črevná dyspepsia, dolný dyspeptický syndróm). Funkčné poruchy sú najčastejšou príčinou návštev pacientov v ambulanciách praktických lekárov a gastroenterológov a nie je možné sa im v každodennej klinickej praxi vyhnúť. (1,2) Etiopatogenéza funkčných porúch nie je doposiaľ úplne objasnená, predstavuje zložitú oblasť gastroenterológie a doposiaľ platí, že veda vie podstatne viac o chorobách organických.
Úvod
Syndróm dráždivého čreva – irritable bowel syndrome (IBS) je jednou z najčastejších funkčných gastrointestinálnych porúch, ktorý sa prejavuje bolesťami brucha, črevnou dyspepsiou a nutkavými defekáciami. (1-5) Rímske kritériá tento stav označujú ako syndróm dráždivého čreva prevažne s hnačkou (IBS-D) alebo dráždivé črevo predominantne so zápchou (IBS-C). Dráždivé črevo s nepravidelnou stolicou (IBS–M), kedy sa striedajú epizódy hnačiek a zápchy a typická je prvá ranná defekácia tuhej stolice následne s vodnatými hnačkami je ďalším sub- typom dráždivého čreva. (1)
Prevalencia syndrómu dráždivého čreva v Európe je 10-25% s prvou manifestáciou ochorenia spravidla vo veku 30-50 rokov, s poklesom výskytu vo vyššom veku pričom ženy sú postihnuté 2-4 krát častejšie ako muži.
Diagnóza syndrómu dráždivého čreva vychádza z typického klinického obrazu, v primeranom rozsahu je však potrebné vylúčiť organické ochorenie. (1,2) Doposiaľ neexistuje žiadne univerzálne „diagnostické minimum“, vždy je treba aktívne pátrať po alarmujúcich príznakoch, pri ktorých je nutné podrobné vyšetrenie pacienta. Gastroenterológ predovšetkým nesmie prehliadnuť vznik ťažkostí u osôb starších ako 50 rokov, úbytok hmotnosti, nočné hnačky a bolesti brucha budiace pacienta zo spánku, enterorágie, abnormálne laboratórne nálezy a patologický nález pri fyzikálnom vyšetrení brucha a per rectum. Liečba syndrómu dráždivého čreva je komplexná s dôrazom na symptómovú zložku. Predpokladom úspešnej liečby je farmakoterapia v kombinácii s diétnymi opatreniami a psychoterapiou.(1-5)
Etiopatogenéza IBS
Úloha črevného mikrobiómu u pacientov so syndrómom dráždivého čreva je nespochybniteľná: ovplyvňuje trávenie a vstrebávanie živín; je zodpovedná za funkciu imunitného systému, najmä za nešpecifickú imunitu, ktorú zabezpečuje imunitné tkanivo spojené s črevom (GALT), a protizápalovú a regulačnú aktivitu GALT; formuje črevnú epitelovú bariéru. (1,6-8) Účasť genetických faktorov podporujú štúdie u jednovaječných dvojčiat. Prítomná je alterovaná gastrointestinálna motilita, zvýšená črevná sekrécia a viscerálna hypersenzitivita.(7-10) Predpokladá sa, že nerovnováha v zložení črevnej mikrobioty interferuje s normálnou funkciou osy „črevo – mozog“, čo vedie k alterácii črevnej motility a celej viscerosenzitívnej siete. (11) Patogenéza tohto ochorenia je teda multifaktoriálna a detailne neobjasnená.(1,6-11)
Butyrát sodný a IBS
Existujú dôkazy o významných zmenách v zložení črevnej mikroflóry u pacientov so IBS. (12-14) Analýzy vzoriek stolice ukázali vo väčšine štúdií znížené podiely rodov Bifidobacterium a Lactobacillus a zvýšené podiely kmeňa Firmicutes: Bacteroidetes. Najnovšia metaanalýza štúdií mikrobiómu zistila u pacientov so IBS v porovnaní so zdravými kontrolami výrazne nižšie množstvo baktérií Lactobacillus, Bifidobacterium a Faecalibacterium prausnitzi, čo sú hlavní producenti butyrátu v čreve. (14)

Okrem toho sa v inej štúdii zistilo zníženie počtu baktérií produkujúcich butyrát u pacientov so IBS-D a IBS-M. (15) Butyrát spolu s acetátom a propionátom sú mastné kyseliny s krátkym reťazcom (SCFA) s biologickými účinkami na gastrointestinálny ekosystém. (16)
Butyrát predstavuje kľúčový zdroj energie pre enterocyty a má trofický účinok na epitel hrubého čreva, čím podporuje obnovu narušenej štrukturálnej a funkčnej integrity epitelovej bariéry.(17) Butyrát môže tiež ovplyvniť zloženie črevnej mikroflóry tým, že inhibuje proliferáciu patogénov a podporuje žiaduce kmene.(18) Okrem toho butyrát priaznivo ovplyvňuje viaceré zápalové cytokíny a aktivitu myeloperoxidázy prostredníctvom inhibície nukleárneho faktora kappa B. (19) Predpokladá sa, že tieto jedinečné vlastnosti butyrátu vedú k viacerým priaznivým účinkom ovplyvňujúcim funkčnosť čreva. Vzhľadom na to, že pacienti so IBS môžu trpieť nízkymi koncentráciami butyrátu v čreve, ako sa uvádza vyššie, predpokladá sa, že cielená suplementácia do distálnych častí čreva pomocou mikroenkapsulovaného butyrátu prospieva pacientom so IBS. (20-22) Prvé relevantné klinické poznatky o pacientoch so IBS, ktorí užívali butyrát sodný v dávke 300 mg denne boli publikované v roku 2007 a 2013. V oboch prípadoch bola zaznamenaná signifikantná úprava stavu a znížená frekvencia klinických symptómov.(20,21)
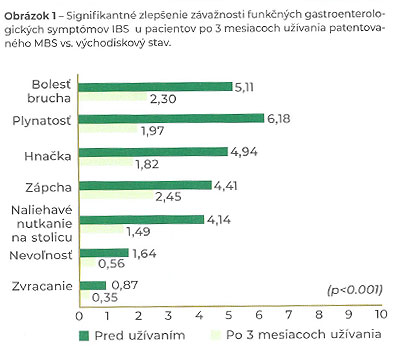
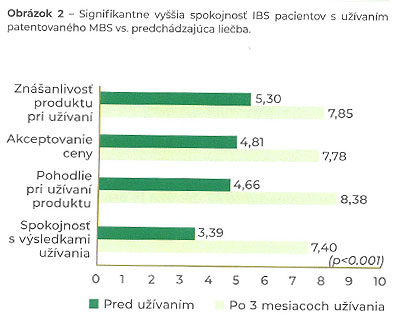
Tieto zistenia potvrdila aj nedávno publikovaná prospektívna multicentricka klinická štúdia na počte 2990 nehospitalizovaných pacientov s potvrdeným IBS. Cieľom štúdie bolo posúdiť účinnosť patentovaného prípravku butyrátu sodného v triglyceridovej matrici (mikroenkapsulovaný butyrát sodný – MBS) na zníženie klinických symptómov a zlepšenie kvality života u pacientov so syndrómom dráždivého čreva (IBS), ktorí boli liečení MBS v dávke 150 mg dvakrát denne počas 12 týždňov. V štúdii sa zaznamenalo signifikantné zlepšenie závažnosti bolesti brucha (p<0,001). Okrem toho sa významne znížila plynatosť, hnačka, zápcha, naliehavé nutkanie na stolicu, nevoľnosť a zvracanie (p<0,001) – Obr. 1. Väčšina respondentov (94%) deklarovala, že by v liečbe pokračovala, a 89% by užívanie daného prípravku s patentovaným mikroenkapsulovaným butyrátom sodným odporučilo ďalším pacientom so IBS (Obr. 2 a Obr. 3). (22)
Synbiotiká a IBS
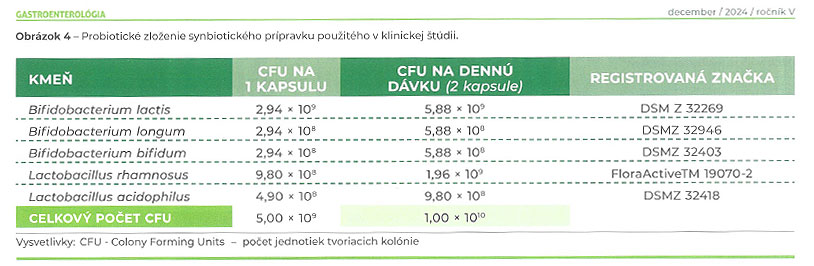
Ďalším prístupom na zvýšenie koncentrácie SCFA v čreve je podávanie probiotík alebo synbiotík (probiotiká v kombinácii s prebiotikami). Tie majú potenciál modifikovať črevnú dysbiózu a zvýšiť produkciu SCFA v čreve, (23) čím prinášajú terapeutické výhody pacientom so IBS. (24-26) Probiotiká sú živé mikroorganizmy, ktoré majú pri podávaní v správnej dávke pozitívny vplyv na ľudské zdravie. (26) Prebiotiká (najčastejšie oligosacharidy, ako sú fruktooligosacharidy (FOS) alebo galaktooligosacharidy) sú substráty, ktoré sú selektívnevyužívané hostiteľskými mikroorganizmami a prinášajú zdravotný prospech. (27) Priaznivé účinky probiotík a synbiotík u pacientov so IBS boli preukázané vo viacerých randomizovaných klinických štúdiách a metaanalýzach. Účinnosť synbiotík pri IBS závisí od kvality a zloženia prípravku, dávky a dĺžky podávania. (24-26,28,29) Nedávno publikované dáta z randomizovanej dvojito zaslepenej, placebom kontrolovanej štúdie ukázali, že viackmeňový synbiotický prípravok obsahujúci probiotické kmene Lactobacillus a Bifidobacterium (patentová značka FloraActiveTM) Obr. 4, a prebiotický FOS s krátkym reťazcom (sc-FOS; patentová značka Actilight®) bol spojený so signifikantným zlepšením symptómov IBS-D a bol bezpečný a dobre tolerovaný.
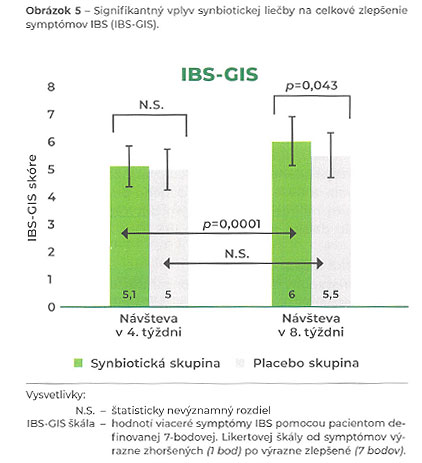
Primárnym cieľom bolo hodnotenie závažnosti symptómov pomocou škály závažnosti symptómov IBS (IBS-SSS), zlepšenie globálnych symptómov IBS pomocou škály globálneho zlepšenia (IBS-GIS) a primerané zmiernenie symptómov po štyroch a ôsmich týždňoch liečby u pacientov so stredne ťažkým a ťažkým IBS-D. IBS-SSS je zložené skóre, ktoré hodnotí bolesti brucha, počet dní s bolesťou brucha, nadúvanie, črevný diskomfort a kvalitu života v spojení so IBS. Škála globálneho zlepšenia (IBS–GIS) je validovaný nástroj, ktorý je užitočný na meranie účinnosti intervencií v oblasti IBS v klinických štúdiách. Liečba synbiotickým preparátom u 68 sledovaných pacientov so IBS-D v porovnaní s placebom signifikantne zlepšila skóre IBS-SSS po štyroch týždňoch (p=0,042) a skóre IBS-GIS (p=0,043) po ôsmich týždňoch užívania (Obr. 5). Pacienti liečení synbiotikami naviac uvádzali v týždenných pozorovaniach významné zlepšenie pocitu neúplnej defekácie, plynatosti, bolesti, tlaku na stolicu a hnačky v porovnaní s pacientmi, ktorí dostávali placebo. Medzi oboma skupinami sa nevyskytli žiadne rozdiely v nežiaducich účinkoch. Tieto výsledky naznačujú, že užívanie tohto synbiotika je pre pacientom so IBS-D prínosné. (30)
Záver
Využitie komplexu synbiotík (probiotiká s prebiotikami) spolu s butyrátom sodným u pacientov s funkčnými poruchami gastrointestinálneho traktu (ako je napríklad IBS) je sľubnou cestou k novým prístupom v liečbe týchto stavov. Ku zlepšeniu klinických príznakov IBS prispieva taktiež diéta s nízkym obsahom FODMAP. Predpokladá sa, že efekt tejto liečby je mediovaný zmenou zloženia črevnej mikrobioty. Hlavne u probiotík stále prevládajú komerčné aspekty a popularizujúce trendy, ich postavenie v liečbe funkčných porúch tráviaceho traktu je však nespochybniteľné.
Viaceré klinické štúdie dokázali zhodnotiť prospešnosť užívania mikroenkapsulovaného butyrátu sodného a vybraných probiotík s prebiotickými fruktooligosacharidmi s krátkym reťazcom na závažnosť klinických symptómov IBS a kvalitu života (IBS-QOL). Ukazuje sa, že táto kombinácia môže pomôcť obnoviť narušenú funkčnosť črevnej mikroflóry a zvýšiť hladinu butyrátu v čreve, čo môže byť prospešné pre pacientov so IBS. V dohľadnej dobe sa očakáva publikácia ďalších chýbajúcich poznatkov ohľadne posúdenia vplyvu uvedenej suplementácie na kompozíciu tela (antropometrické parametre, BMI) a taktiež ich vplyv na zápalové procesy prítomné u pacientov so IBS (analýza vybraných sérologických biomarkerov; IL-6, MIP-1B).
GASTROENTEROLÓGIA december/2024/ročník V
Použitá literatúra
1. Ford A.C., Lacy B.E.; Talley, N.J. Irritable bowel syndrome. N. Engl. J. Med. 2017, 376, 2566-2578.
2. Konečný, M., Ehrmann, J. I. interní klinika LF a FN, Olomouc. Liečba dráždivého čreva. Z klinickej praxe. Dostupné na: www.edukafarm.sk/data/soubory//casopisy/ mediNEWS/01-2014/12%20LIECBA%20DRAZDIVEHO%20CREVA.pdf. 3. Canavan, C.; West, J.; Card, T. The epidemiology of irritable bowel syndrome. Clin. Epidemiol. 2014, 6, 71-80.
3. Lovell, R.M.; Ford, A.C. Global prevalence of and risk factors for irritable bowel syndrome: A meta-analysis. Clin. Gastroenterol. Hepatol. 2012, 10, 712-721.
4. Sperber, A.D.; Bangdiwala, S.I.; Drossman, D.A.; et al. Worldwide prevalence and burden of functional gastrointestinal disorders, results of Rome Foundation global study. Gastroenterology 2020, 160, 99-114.
5. Vivinus-Nébot, M.; Frin-Mathy, G.; Bzioueche, H.; et. al. Functional bowel symptoms in quiescent inflammatory bowel diseases: Role of epithelial barrier disruption and low-grade inflammation. Gut 2014, 63, 744-752.
6. Moloney, R.D.; Johnson, A.C.; O’Mahony, S.M.; et. al. Stress and the microbiota gut-brain axis in visceral pain: Relevance to irritable bowel syndrome. CNS Neurosci. Ther. 2016, 22, 102-117.
7. Zhou, S.Y.; Gillilland, M.; Wu, X.; et. al. FODMAP diet modulates visceral nociception by lipopolysaccharide-mediated intestinal inflammation and barrier dysfunction. J Clin. Investig. 2018, 128, 267-280.
8. Bhattarai, Y.; Muniz Pedrogo, D.A.; Kashyap, P.C. Irritable bowel syndrome: A gut microbiota-related disorder? Am. J. Physiol. Gastrointest. Liver Physiol. 2017, 312, G52-G62.
9. Mari, A.; Baker, F.A.; Mahamid, M.; et. al. The evolving role of gut microbiota in the management of irritable bowel syndrome: An overview of the current knowledge. J. Clin. Med. 2020, 9, 685.
10. Lynch, S.V.; Pedersen, O. The human intestinal microbiome in health and disease. N. Engl. J. Med. 2016, 375, 2369-2379.
11. Carroll, I.M.; Ringel-Kulka, T.; Siddle, J.P.; et. al. Alterations in composition and diversity of the intestinal microbiota in patients with diarrhea-predominant irritable bowel syndrome. Neurogastroenterol. Motil. 2012, 24, 521-530.
12. Kerckhoffs, A.P.; Samsom, M.; van der Rest, M.E.; et. al. Bifidobacteria counts in both duodenal mucosa-associated and fecal microbiota in irritable bowel syndrome patients. World J. Gastroenterol. 2009, 15, 2887-2892.
13. Liu, H.N.; Wu, H.; Chen, Y.C.; et. al. Altered molecular signature of intestinal microbiota in irritable bowel syndrome patients compared with healthy controls: A systematic review and meta-analysis. Dig. Liver Dis. 2017, 49, 331-337.
14. Pozuelo, M.; Panda, S.; Santiago, A.; et. al. Reduction of butyrate- and methane-producing microorganisms in patients with Irritable Bowel Syndrome. Sci Rep. 2015, 5, 12693.
15. Campos-Perez, W.; Martinez-Lopez, E. Effects of short chain fatty acids on metabolic and inflammatory processes in human health. Biochim. Biophys. Acta Mol. Cell Biol. Lipids 2021, 1866, 158900.
16. Parada Venegas, D.; De la Fuente, M.K.; Landskron, G.; et. al. Short Chain Fatty Acids (SCFAs)-Mediated Gut Epithelial and Immune Regulation and Its Relevance for Inflammatory Bowel Diseases. Front. Immunol. 2019, 11, 277.
17. Li, K.; Zeng, Z.; Liu, J.; et. al. Effects of Short-Chain Fatty Acid Modulation on Potentially Diarrhea-Causing Pathogens in Yaks Through Metagenomic Sequencing. Front. Cell. Infect. Microbiol. 2022, 12, 805481.
18. Siddiqui, M.T.; Cresci, G.A.M. The Immunomodulatory Functions of Butyrate. J. Inflamm. Res. 2021, 18, 6025-6041.
19. Scarpellini, E.; Lauritano, E.C.; Lupascu, A.; et. al. Efficacy of butyrate in the treatment of diarrhoea-predominant irritable bowel syndrome. Digestive and Liver Disease Supplements. Volume 1, Issue 1, September 2007, Pages 19-22.
20. Banasiewicz, T.; Krokowicz, Ł.; Stojcev, Z.; et. al. Microencapsulated sodium butyrate reduces the frequency of abdominal pain in patients with irritable bowel syndrome. Color. Dis. 2013, 15, 204-209.
21. Lewandowski, K.; Kaniewska, M.; Karłowicz, K.; et. al. The effectiveness of microencapsulated sodium butyrate at reducing symptoms in patients with irritable bowel syndrome. Gastroenterology Rev 2022; 17 (1): 28-34.
22. Cremon, C.; Guglielmetti, S.; Gargari, G.; et al. Effect of Lactobacillus paracasei CNCM I-1572 on symptoms, gut microbiota, short chain fatty acids, and immune activation in patients with irritable bowel syndrome: A pilot randomized clinical trial. United Eur. Gastroenterol. J. 2018, 6, 604-613.
23. Li, B.; Liang, L.; Deng, H.; et. al. Efficacy and safety of probiotics in irritable bowel syndrome: A systematic review and meta-Analysis. Front. Pharmacol. 2020, 11, 332.
24. Ford, A.C.; Harris, L.A.; Lacy, B.E.; et. al. Systematic review with meta-analysis: The efficacy of prebiotics, probiotics, synbiotics and antibiotics in irritable bowel syndrome. Aliment. Pharmacol. Ther. 2018, 48, 1044-1060.
25. Akutko, K.; Stawarski, A. Probiotics, Prebiotics and Synbiotics in Inflammatory Bowel Diseases. J. Clin. Med. 2021, 10, 2466.
26. Gibson, G.R.; Hutkins, R.; Sanders, M.E.; et al. Expert consensus document: The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics. Nat. Rev. Gastroenterol. Hepatol. 2017, 14, 491-502.
27. Niu, H.L.; Xiao, J.Y. The efficacy and safety of probiotics in patients with irritable bowel syndrome: Evidence based on 35 randomized controlled trials. Int. J. Surg. 2020, 75, 116-127.
28. Liang, D.; Longgui, N.; Guoqiang, X. Efficacy of different probiotic protocols in irritable bowel syndrome: A network meta analysis. Medicine 2019, 98, e16068.
29. Skrzydło-Radomanska, B.; Prozorow-Król, B.; Cicho z-Lach, H.; et. al. The effectiveness of synbiotic preparation containing Lactobacillus and Bifidobacterium probiotic strains and short chain fructooligosaccharides in patients with diarrhea predominant irritable bowel syndrome-a randomized double-blind, placebo-controlled study. Nutrients 2020, 12, 1999.
